13 января 2021 года
состоялось
очередное заседание Президиума Российской академии наук
(проводится в режиме видеоконференции)
Председательствует президент
РАН академик РАН Александр Михайлович
Сергеев.
Члены Президиума заслушали сообщение «Регенеративная
биомедицина: фундаментальные и прикладные аспекты».
В заседании принимают участие:
Член-корреспондент
РАН Вероника Игоревна Скворцова —
Руководитель ФМБА России.
Татьяна Владимировна Семёнова — заместитель Министра Минздрава России.
Игорь Викторович
Коробко — директор Департамента науки,
инновационного развития и управления медико-биологическими рисками здоровью
Минздрава России.
Дарья Сергеевна Крючко —
начальник Управления трансляционной медицины и инновационных технологий ФМБА России.
Докладчик — академик РАН Всеволод
Арсеньевич Ткачук, президент
Общества регенеративной медицины, декан Факультета фундаментальной медицины МГУ
имени М.В. Ломоносова.
Тема доклада посвящена рассмотрению фундаментальных и прикладных
проблем регенеративной биомедицины.
Эта наука возникла в конце прошлого века. Сейчас она стремительно
развивается в направлении выяснения механизмов обновления клеток, регенерации и
репарации тканей, а также создания принципиально новых методов излечения
тяжелых заболеваний, связанных с повреждением и утратой жизненно важных клеток
и тканей в организме человека.
В настоящее время ведется более тысячи клинических испытаний
препаратов, основанных на методах клеточной и генной терапии и направленных на
лечение онкологических и аутоиммунных заболеваний, инфаркта миокарда и
сердечной недостаточности, диабета 1 типа, повреждений спинного мозга, болезней
Альцгеймера и Паркинсона и других заболеваний, для которых не существует
обычных методов излечения.
В Институте регенеративной медицины МНОЦ МГУ имени М.В. Ломоносова
проводятся предклинические исследования и клинические испытания ряда
препаратов, которые стимулируют прорастание нервных волокон после
трансплантации пальцев и кистей рук, а также для устранения неврологических
дисфункций после геморрагического инсульта. Для лечения мужского бесплодия
создается препарат, стимулирующий сперматогенез и возвращающий фертильность.
Создан тканеинженерный конструкт из мезенхимных стромальных клеток, который в
эксперименте на животных позволяет излечивать пролежни. Выявлены и
идентифицированы микроРНК, которые оказывают антифиброзное действие на коже и в
легких. Показано существование растворимого в плазме крови человека вещества,
которое секретируется клетками эндометрия и предотвращает фиброз как тканей
матки, так и других органов. Ведется идентификация этого вещества с целью
создания антифиброзного препарата. Показано, что рост кровеносных сосудов и
нервных волокон происходит под контролем навигационных рецепторов, которые
узнают, как градиенты в концентрации веществ-«аттрактантов», так и веществ-«репеллентов»,
выделяемых тканями при повреждении и заживлении ран. Доказано, что рецептор
урокиназного активатора плазминогена (uPAR) осуществляет навигационные функции,
локализуясь на конусе роста аксонов или на лидирующей поверхности роста
сосудов. Этот же рецептор играет ключевую роль в формировании когнитивных
функций мозга, так как в эмбриогенезе стимулирует перемещение нейронов в кору
головного мозга, а генетический дефект uPAR коррелирует с развитием когнитивных
нарушений и эпилепсией как у животных, так и у людей.
Человеческий организм является «самообновляющейся машиной». В
течение жизни он производит десятки тонн клеток, то есть обладает могучим
регенеративным потенциалом, который следует использовать в современной
медицине. В последнее десятилетие появилось понимание как механизмов регуляции
гибели клеток и их образования под действием эндогенных регуляторов, а также
внешней среды.
* *
Член-корреспондент РАН Елена Викторовна Парфенова — директор Института
экспериментальной кардиологии ФГБУ
НМИЦ кардиологии Минздрава России.
Доклад посвящен разработке подходов к
сохранению жизнеспособности и регенеративных свойств стволовых клеток при
трансплантации в поврежденное сердце. Хорошо известно, что при используемых
сегодня способах трансплантации стволовых клеток в виде суспензии — большая их
часть гибнет в первые же дни после введения в сердце, что определяет невысокую
эффективность клеточной терапии заболеваний сердца. Необходимо постулировать,
что основная причина заключается в том, что стволовые клетки не автономны, они
функционируют в специальном микроокружении — клеточных нишах, в которых их
функции регулируются контактами с другими клетками и с внеклеточным матриксом, паракринными
сигналами — факторами роста, пептидами, микровезикулами, метаболическими
сигналами. Ниша контролирует, направляет и поддерживает жизнь и
функционирование стволовых клеток. Выделение клеток из тканей лишает их этих
регуляторных воздействий, что и приводит к гибели большей части введенных
клеток. Для преодоления этой проблемы в ФГБУ НМИЦ кардиологии разработан метод
получения клеточных пластов из прогениторных клеток, которые отчасти
воспроизводят микроокружение тканевой клеточной ниши. Показано, что
трансплантация таких клеточных пластов на область экспериментального инфаркта
стимулирует эндогенные регенеративные процессы и восстановление функции сердца
за счет паракринной активности клеток пласта, которые остаются жизнеспособными
и функционально активными в течение нескольких недель. Сейчас авторы приступают
к тестированию этой технологии на крупных животных для последующего перехода к
клиническим испытаниям.
* *
Член-корреспондент РАН Елена Вадимовна Загайнова — ректор ННГУ им. Н.И Лобачевского, к.б.н. Кузнецова
Дарья Сергеевна, к.б.н.
Александра Викторовна Мелешина — ПИМУ
Минздрава России.
«Клеточные
технологии для лечения заболеваний паренхиматозных органов»
Трансплантация
островков Лангерганса (ОЛ) поджелудочной железы (ПЖ) является
альтернативным инструментом для лечения диабета первого типа. Основным
фактором, осложняющим применение этой технологии, является иммунная реакция
реципиента на трансплантационный материал. Инкапсуляция островковых клеток
позволяет уходить от иммунного ответа и проводить процедуру трансплантации без
последующей пожизненной иммуносупрессии. Таким образом, объединение методов
клеточных технологий с достижениями полимерной химии для создания капсул
становится чрезвычайно важным направлением для поиска новых подходов лечения
диабета первого типа. Самым распространенным подходом является
микроинкапсуляция. Тестируются разнообразные материалы для создания
микрокапсул, однако наибольшую популярность имеют капсулы из альгината и его
модификаций, так как они инертны, прочны, имеют гладкую поверхность и
гидрофильны, что значительно снижает адсорбцию белка и прикрепление клеток. До
сих пор остается нерешенной проблема подбора оптимальных параметров капсул
(архитектоника, размер капсулы и размер ее пор), а также ее стабильности и
антифиброзных свойств. Несомненно, эффективное выделение и очистка
жизнеспособных качественных ОЛ из ткани поджелудочной железы является решающим
шагом на пути к созданию технологии. В настоящем исследовании отработан и
поставлен протокол выделения ОЛ человека и экспериментальных животных. Ведется
разработка новой альгинатной микрокапсулы. Разработана, сконструирована и
изготовлена лабораторная микрофлюидная установка по синтезу микрокапсул из
альгинатного композита. Экспериментально определены оптимальные режимы работы
лабораторной установки (скорость выдавливания альгинатного композита, длина и
период импульсов потока непрерывной фазы, давление в напорной камере) для
формирования монодисперсных сферических микрокапсул. Разработаны методики
эмульсионного и микрофлюидного синтеза альгинатных микрокапсул и получены
стабильные альгинатные микрокапсулы сферической формы диаметром 380 мкм. Кроме
того, до сих пор не решена проблема экспресс-оценки качества материала
поджелудочной железы и количества жизнеспособных и метаболически активных
островков в ней, которая не требовала бы разрушения ее структуры и
использования экзогенных красителей. В данном исследовании разработан метод
оценки на основе FLIM (микроскопии с детекцией времени жизни флуоресценции) и
автофлуоресценции внутриклеточного метаболита (НАД(Ф)Н) для неинвазивной и
бесконтрастной (label-free) оценки качества островковых клеток поджелудочной железы.
Метаболический
имиджинг дифференцировки стволовых клеток. Индуцированные
плюрипотентные стволовые клетки (ИПСК) и мезенхимные стволовые клетки (МСК) на
сегодняшний день остаются самыми перспективными инструментами для задач
клеточной терапии. Однако опыт использования ИПСК показывает не только их
перспективность как источника восстановительного роста, но, вместе с тем, и
потенциальную опасность. Одним из основных препятствий для клинического
применения ИПСК являются недифференцированные и/или не прошедшие до конца
дифференцировку стволовые клетки (СК), контаминирующие дифференцированную
культуру и представляющие собой риск развития опухоли (тератомы) и развитие
иммунного ответа после трансплантации. Остается актуальным анализ эффективности
новых технологий запуска дифференцировки СК с целью их развития в определенный
функционально активный клеточный тип. Только после включения программы на
определенный путь дифференцировки клеточная терапия на основе СК может стать
потенциально безопасной и эффективной. Особого внимания заслуживает поиск
нового параметра для эффективного малоинвазивного метода оценки степени
дифференцировки СК, внедрение которого в биотехнологическую практику, позволит
сделать методы клеточной терапии на основе СК потенциально безопасными и
эффективными. В данном исследовании на основе динамического наблюдения
метаболического статуса с использованием FLIM имиджинга собственных
внутриклеточных флуорофоров (НАД(Ф)Н и ФАД) разработан эффективный
малоинвазивный метод отбора дифференцированных клеток от СК. Впервые с
использованием данного метода на модели адипогенной дифференцировки МСК
выполнено разделение фосфорилированной и нефосфорилированной формы НАДН. На 2
типах СК (ИПСК и МСК) и 7 направлениях дифференцировок (адипогенной,
хондрогенной, остеогенной, нейральной, эндотелиальной, дермальной и эпидермальной)
выявлены значимые изменения в метаболическом статусе СК в процессе направленных
дифференцировок (переход от более гликолитичного фенотипа к окислительному
фосфорилированию). С применением методов машинного обучения выявлена
кластеризация изучаемых FLIM
параметров в зависимости от типа клеток. В дальнейшем методы машинного обучения
и FLIM сортинг позволят создать
новый эффективный малоинвазивный метод качественного контроля дифференцировки
стволовых клеток.
Прогностические
показатели регенерация печени. В настоящее время хирургическая резекция
признана наиболее эффективным методом лечения необратимых очаговых заболеваний
печени во всем мире. Одним из главных лимитирующих факторов выполнения обширной
резекции является остаточный критический объем паренхимы печени после резекции,
необходимый для обеспечения основных функций, дефицит которого достоверно
повышает риск развития синдрома недостаточного объема печени и
послеоперационной летальности. Патогенез развития синдрома недостаточного
объема печени определяется как массой остающейся части печени, так и исходным
состоянием гепатоцитов, что в целом обуславливает способность печени к
регенерации. Таким образом, актуальной задачей является разработка метода
предиктивной оценки состояния ткани печени и определение таких маркеров, по
которым можно было бы судить о степени регенерации печени на начальном этапе
резекции интраоперационно. Для разработки такого комплексного подхода мы
предлагаем использование современных технологий оптического биоимиджинга и химического
картирования. Разрабатываемый подход оценки регенераторного потенциала печени
может быть транслирован в практическую медицину, поскольку существует приборная
реализация мультифотонной микроскопии для прижизненного исследования органов и
тканей пациентов (система MPT Flex с FLIM и SHG), что позволит интраоперационно
проводить экспресс оценку состояния печеночной паренхимы и анализировать
регенераторный потенциал печени в целом.
На первом этапе исследования проведено
моделирование острой и хронической патологии печени у лабораторных животных — холестаз
и фиброз. Выявлено развитие неоднородности ткани печени при патологии по уровню
сигнала флуоресценции НАД(Ф)Н в гепатоцитах. Обнаружен сдвиг метаболизма в
сторону гликолиза в поврежденных областях как в случае острой, так и
хронической патологии. При холестазе видны зоны с ярко выраженным накоплением
билирубина уже на начальных стадиях развития патологии. В случае фиброза можно
наблюдать скопление коллагеновых волокон в зонах повреждения гепатоцитов. В поврежденной печени при обеих патологиях
наблюдается снижение сигнала от ненасыщенных и полиненасыщенных жирных кислот.
Второй этап исследования заключался в
анализе структурно-функционального состояния печени в процессе регенерации. Для
этого у лабораторных животных проводили 30% и 70% гепатэктомию печени.
Обнаружено, что в процессе регенерации происходит значительное увеличение
вклада связанных форм НАДН и НАДФН, что может указывать на рост энергозатрат
гепатоцитов в процессе регенерации, которые компенсируются за счет более
интенсивных процессов окислительного фосфорилирования. Увеличение вклада НАДФН
может являться следствием активно протекающих процессов биосинтеза новых
молекул в делящихся гепатоцитов. Наиболее важным результатом данного этапа
работ стало построение корреляционных матриц исследуемых параметров FLIM,
количества пролиферирующих клеток и процента восстановления печени. Мы
обнаружили достоверную корреляцию параметра процента восстановления печени с
вкладом НАДФН до индукции регенерации. Высокие значения данного параметра можно
считать одним из критериев успешной регенерации печени.
* *
Член-корреспондент РАН Андрей Валентинович Васильев — врио
директора Института биологии развития им. Н. К. Кольцова РАН.
Проблемы
развития клеточных технологий:
Отсутствие
целевой программы разработки клинически значимых клеточных продуктов,
включающая ресурсы для проведения доклинических, технологических и клинических
исследований;
Отсутствует
интегрированная программа исследований свойств и функционального статуса клеток
организма человека;
Необходимость
создания общегосударственной сети банков клеток и биомедицинских клеточных
продуктов для клинического применения
Необходима
целевая поддержка, поскольку клеточно-биологические исследования отличаются
высокой затратностью.
* *
Доктор биологических наук Елена Валентиновна Казначеева — руководитель
отдела молекулярной физиологии клетки, Институт цитологии РАН,
Санкт-Петербург.
«Клеточное репрограммирование для
исследования кальциевого сигналинга при нейродегенеративных процессах».
Платформа для скрининга
потенциальных лекарственных препаратов.
Основа жизнедеятельности клетки во многом
определяется процессами внутриклеточного сигналинга, среди которых, особое
место занимает кальциевый сигналинг, поскольку практически все внутриклеточные
процессы регулируются ионами кальция. Основными воротами для поступления
кальция в клетку являются ионные кальциевые каналы — белковые структуры
расположенные в плазматической мембране клетки. Дисфункция кальциевых каналов
ассоциирована с большим количеством патологических состояний. В последнее время
однозначно установлено, что целый ряд нейродегенеративных процессов
непосредственно связан с изменением функционирования кальциевых каналов. В
сообщении высказано предположение о роли дисфункции кальциевых каналов в развитии
ген-опосредованных полиглутаминовых нейродегенеративных заболеваний.
Полиглутаминовые заболевания ‒ наследственные патологии, обусловленные
экспансией тринуклеотидных CAG-повторов в кодирующей части определенных генов.
Это приводит к появлению в клетках белков со сверхдлинными полиглутаминовыми
трактами. В исследовании продемонстрировано значение клеточного
репрограммирования для исследования фундаментальных основ патогенеза полиглутаминоввых заболеваний показана возможность
использования платформы клеточного репрограммирования для адекватного поиска и
валидации новых терапевтических агентов для лечения нейродегенеративных
процессов. Одним из классических полиглутаминовых заболеваний является болезнь
Гентингтона (БГ), в ходе течения которой поражаются в основном GABA-эргические
нейроны стриатума. Если генетические предпосылки БГ очевидны, то молекулярная
природа развития заболевания до сих пор не вполне известна. Впервые проведено
электрофизиологическое описание репрограммированных патологических нейронов.
Показано аномальное увеличение поступления ионов кальция в
пациент-специфические нейроны стриатума. Были идентифицированы
потенциал-управляемые и депо-управляемые каналы, опосредующие большой
кальциевый ток при патологии. Путем широформатного скринига химических
соединений найдена кандидатная молекула EVP 4593, которая улучшала моторные
функции особей Drosophila melanogaster с мутантными формами белка хентингтина и
проявляла нейропротекторный эффект. EVP4593 в остром эксперименте уменьшает
кальциевый ток в «гентингтон-специфичных» нейронах человека до нормального
уровня. Суточная инкубация с EVP оказывала нейропротекторное влияние на «гентингтон-специфичные»
нейроны человека. Выявлено значительное увеличение экспрессии хантингтина, как
мутантной, так и нормальной формы в гентингтон-специфичных нейронах, а также
увеличение уровня одного из ключевых регуляторов кальциевых каналов белка
STIM2. 24х-часовая инкубация с EVP4593 вызывала снижение уровня экспрессии этих
белков, что приводило и к нормализации кальциевого сигнала и к элимминации
токсических функций мутантного хантингтина. Таким образом объяснен возможный
молекулярный механизм нейропротекции EVP. Таким образом, нами предложены
элементы кальциевого сигналинга, как новые потенциальные мишени в терапии БГ, а
агент EVP4593 может служить прототипом лекарственного средства.
Нас интересовал также вопрос селективной
гибели нейронов. Известно, что разные нейродегенеративные заболевания
характеризуются разными паттернами гибели нейронов. Природа этого явления до
сих пор окончательно не известна.
Нами проведено сравнение кальциевого
сигналинга в нейронах стриатума, репрограмированных из клеток пациентов с
полиглутаминовыми заболеваниями такими как БГ, спинноцеребелярная атаксия 1 и
17 типов. При болезни Гентингтона и атаксии 17 типа наиболее пострадавшим
является именно эти нейроны, тогда как при атаксии 1 го типа страдают нейроны
мозжечка. Эксперименты показали, что нарушение кальциевого сигналинга
наблюдается лишь в том типе нейронов, которые погибают в ходе развития данных
заболеваний. В этой связи можно весьма обоснованно предположить, что именно в
кальциевой дисрегуляции и заключается причина селективной гибели нейронов.
* *
Член-корреспондент РАН Людмила Борисовна Буравкова — заместитель директора ГНЦ РФ — ИМБП
РАН, Лаборатория клеточной физиологии.
«Мультипотентные
мезенхимальные стромальные клетки в процессах клеточной и тканевой регенерации:
влияние факторов микроокружения».
Сейчас
уже очевидно, что популяция клеток, определяемая как мультипотентные
мезенхимальные стромальные/стволовые клетки (МСК), является одним из ключевых
участников тканевого гомеостаза и представляет собой составную часть
гистогенетически единого компартмента стромальных клеток. Тем не менее,
практически все современные представления о свойствах МСК были получены in vitro в результате исследования клеточной
популяции, выделяемой ферментативно из различных тканей, и обладающей рядом
характерных, но не уникальных признаков. Вопрос о in vivo локализации
клеток, которые in vitro позиционируются
как МСК, в течение длительного времени оставался непроясненным, несмотря на
существование гипотетических представлений о возможном периваскулярном
расположении депо малодифференцированных стромальных предшественников.
Использование имуноцитохимического похода позволило выявить в сосудах как
микроциркуляторного, так и макроциркуляторного русла сеть субэндотелиальных
перицитоподобных клеток, обладающих in vitro характеристиками МСК. В дальнейшем, клетки с
подобными свойствами были выделены не только из стенок сосудов, но и в составе
стромально-васкулярной фракции из многих органов с хорошо развитой
микрососудистой сетью. В настоящее время именно периваскулярная тканевая ниша
рассматривается как основное место локализации малодифференцированных
стромальных предшественников in vivo, при
культивировании формируют популяцию, соответствующую по своим свойствам МСК.
Эксперименты in vitro по-прежнему остаются практически
единственным экспериментальным способом анализа различных функциональных
возможностей МСК, хотя развитие молекулярно-клеточных подходов, позволяющих
отслеживать судьбу конкретных клеток в организме, открывает новые перспективы
по изучению МСК в их «естественной» среде обитания. В течение двух последних
десятилетий в результате многочисленных исследований, выполненных на
культивируемых МСК, накоплен значительный экспериментальный материал,
позволяющий формулировать гипотезы о возможных механизмах участия МСК в
физиологическом и репаративном ремоделировании. Предполагается, что способность МСК продуцировать биологически активные метаболиты
(цитокины, молекулы адгезии, компоненты внеклеточного матрикса и др.)
обеспечивает специфическое микроокружение различных клеточных популяций. В то
же время сами МСК являются объектом, на который оказывают влияние клеточные и
неклеточные компоненты тканевых ниш, среди которых важнейшим физическим
фактором является низкое парциальное давление О2. Совершенно
очевидно, что в реализации потенций МСК концентрация О2, может
играть важнейшую роль. Эффекты низкого содержания О2
на свойства МСК интенсивно исследуются в течение последних 15 лет, о чем
свидетельствует возрастающее год от года число публикаций по этому вопросу.
Использование в экспериментах пониженного,
по сравнению с атмосферным, содержания О2, характерного для тканевых
депо МСК, все больше привлекает интерес. В нашей лаборатории в одной из первых
этот экспериментальный подход получил широкое применение. Данные проведенного
комплексного анализа функциональной активности МСК из стромально-васкулярной
фракции жировой ткани в условиях «физиологической» гипоксии (5% О2),
т.е. при концентрации О2, близкой к тем условиям, при которых МСК
существуют в тканевых нишах in situ, выявил ряд
особенностей, которые могут определять эффективность вовлечения этих клеток в
процессы физиологического и репаративного ремоделирования.
Эти результаты существенно расширили и
дополнили имевшиеся представления об эффектах постоянной экспансии МСК из
различных источников при низких концентрациях О2. Вопреки
распространенному мнению о повреждающем действии снижения содержания О2
на клетки, в условиях «физиологической» гипоксии МСК сохраняли мезенхимальный
иммунофенотип (CD90+, CD73+, CD105+),
и высокую жизнеспособность. Отсутствие закисления лизосомального компартмента и
гиперпродукции АФК указывало на отсутствие повреждения МСК при постоянном
культивировании в условиях «физиологической» гипоксии несмотря на снижение
трансмембранного потенциала митохондрий.
Транскрипционный
профиль МСК при «физиологической» гипоксии можно было бы охарактеризовать как «прорегенеративный»,
обеспечивающий возможность реализации функциональной активности, связанной с
физиологическим и репаративным ремоделированием микроокружения. Действительно, по сравнению со стандартными
условиями (20% О2), при 5% О2 функциональная активность
МСК изменялась весьма существенно: клеточная популяция быстрее прирастала,
чувствительность к остео- и адиподифференцировочным стимулам при этом
снижалась. Такой сдвиг в соотношении потенциала пролиферация/дифференцировка
указывает на меньшую степень коммитированности МСК при «физиологической»
гипоксии, подтверждаемый и увеличением транскрипции генов DMKN, LAMA1, GPR56, которые связывают с обеспечением «пластичности»
МСК.
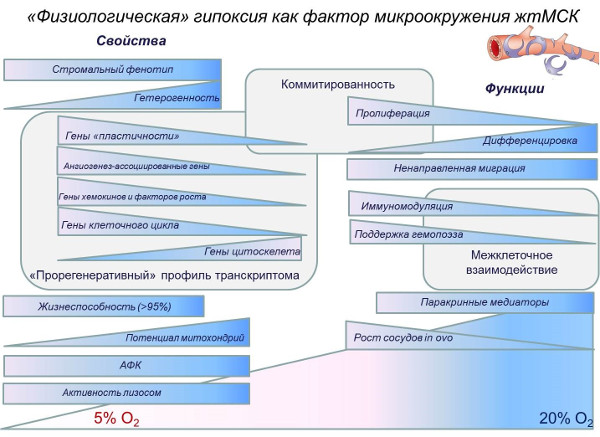
Рис. Влияние постоянного
культивирования в условиях «физиологической» гипоксии на состояние МСК и их
функциональную активность
После
коротких гипоксических экспозиций были продемонстрированы как повреждающие, так
и стимулирующие эффекты на МСК. Известно, что такое воздействие приводит к
активации целого ряда стресс-индуцируемых сигнальных путей, таких как каскады
митоген-активируемых протеинкиназ (MAPK). Обладая высокой
пластичностью, МСК, постоянно культивируемые при 20% О2,
адаптировались к воздействию кратковременного снижения О2,
существенным образом изменяя свою функциональную активность. В частности,
показано увеличение их способности к миграции и стимуляции ангиогенеза. Однако,
как уже обсуждалось, свойства МСК и при «физиологической» гипоксии существенно
отличаются от тех, которые они имеют при стандартных условиях культивирования
(20% О2), которые, по сути дела, являются для клеток
гипероксическими. Соответственно, реакция МСК в условиях «физиологической»
гипоксии на резкое снижение концентрации О2 может отличаться от
того, что известно для МСК при 20% О2. Как показано в нашей
лаборатории МСК, экспансия которых велась при «физиологической» гипоксии, были
устойчивы к краткому гипоксическому стрессу, сохраняя высокую жизнеспособность,
трансмембранный потенциал митохондрий. У них увеличивалась ангиогенная активность,
но была снижена способность к миграции, что может быть связано с удержанием
этих клеток в местах повреждения.
Несмотря
на значительный прогресс, достигнутый в идентификации тканевых локусов МСК и
растущего понимания их роли, как ключевого участника физиологического и
репаративного ремоделирования тканей, этот тип клеток остается одним из
наиболее «иллюзорных» в связи с отсутствием экспериментальных подходов для
анализа их функциональной активности in vivo. Сейчас уже
очевидно, что при формировании тканевого микроокружения МСК не только реализует
стромальную функцию, но и являются источником различных биологически активных
молекул, обеспечивающих функционирование тканевых ниш, наиболее ярким примером
которой является гемопоэтическая ниша.
В
поврежденных же участках МСК скорее всего выполняют роль защитно-трофических
клеток, обеспечивая формирование регенеративного микроокружения, в первую
очередь, за счет паракринных медиаторов, которые ингибируют апоптоз и
формирование рубца, активируют ангиогенез и стимулируют резидентные клетки к
восстановлению их функционального статуса. Как в локальных тканевых депо, так и
в поврежденных тканях в реализации свойств МСК важнейшую роль играют факторы
микроокружения, в частности, парциальное давление кислорода. Низкое содержание
кислорода в физиологических нишах МСК может обеспечить поддержание
недифференцированного статуса этих клеток и необходимую пластичность, к
примеру, ускоренную пролиферацию при мобилизации клеток из депо. С другой
стороны, ишемия в участках повреждений запускает целый каскад молекулярных
изменений, индуцирующих миграцию и обеспечивающих хоуминг МСК в ткани-мишени.
Кроме того, низкое парциальное давление кислорода, по-видимому, может усиливать
репаративный потенциал МСК, обеспечивая эффективную реализацию регенеративной
программы.
Та
информация, которую мы получаем в результате in vitro экспериментов,
по-прежнему остается основным каналом для расширения наших представлений о
потенциале этих клеток. Было бы неверно рассчитывать, что поведение МСК при
культивировании, соответствует их активности in vivo. Более логичным
будет предположение, что условия, создаваемые in vitro, дают возможность
клеткам продемонстрировать их латентный потенциал. Именно поэтому моделирование
особенностей физиологического микроокружения имеет первостепенное значение. Это
предположение в полной мере подтверждается данными, согласно которым постоянное
культивирование при «физиологической» гипоксии не только не оказывает
повреждающего действия на клетки, но и приводит к их модификации, проявляющейся
в обеспечении низко коммитированного статуса и поддержании иммуносупрессивного
потенциала.
Важнейшим
свойством МСК является их способность модулировать функции других клеток. В
условиях «физиологической» гипоксии проанализированы особенности взаимодействия
МСК и клеток гемопоэтического дифферона разной степени коммитированности — митоген-стимулированных
аллогенных мононуклеарных клеток (МНК), а также гемопоэтических стволовых и
прогениторных клеток (ГСПК) из пуповинной крови.
В
присутствии МСК продемонстрировано изменение субпопуляционного состава
Т-клеток, а также снижение их пролиферации и активации. В МСК после
взаимодействия с лимфоцитами происходило подавление пролиферации и остео- и
адиподифференцировки. МСК. Эти эффекты регулировались как за счет паракринных
медиаторов, так и путем непосредственных взаимодействий «клетка-клетка», причем
отсутствие прямого контакта ослабляло подавление пролиферации лимфоцитов и
замедление остеодифференцировки МСК. Цитокиновый профиль при взаимодействии МСК
с Т-клетками характеризовался существенным сдвигом в соотношении про- (ИЛ-6,
ИЛ-8) и антивоспалительных (ИЛ-10, ИФН-гамма) медиаторов в сторону последних и
подавлением продукции хемоаттрактантных молекул ИЛ-8 и МСР-1. При пониженном
содержании О2 иммуносупрессивные свойства МСК дополнительно
потенцировались, снижение пролиферации МСК было менее выражено, а замедление
остедифференцировки — более значительным.
Приведенные экспериментальные данные
существенно расширяют представления об исходе взаимодействия иммунных и
стромальных клеток, показывая, что степень и характер эффектов зависит как от
непосредственного контакта «клетка-клетка», так и от действия растворимых
медиаторов и может быть модифицировано в зависимости от концентрации О2
в тканевом микроокружении. Кроме того, результаты позволяют предположить, что
взаимодействие с иммунными клетками не приведет к существенному изменению
функциональных свойств аллогенных МСК, которые они смогут реализовать в областях
регенерации и репарации, сохраняя при этом иммунотолерантность и иммуносупрессивную
активность.
В результате изучения взаимодействия МСК и
ГСПК из пуповинной крови разработана технология (патенты РФ №2525143, №2628092), позволяющая эффективно
поддерживать самообновление и дифференцировку ГСПК ex
vivo в присутствии МСК, предкультивированных при 5% О2.
За счет адгезии к МСК клеток пуповинной крови были выделены ГСПК, потомки
которых при дальнейшей экспансии образовывали суспензионную и
строма-ассоциированные популяции. Взаимодействие с ГСПК приводит к увеличению в
МСК экспрессии генов адгезивных молекул ICAM-1,
VCAM-1, CDH1 и снижению экспрессии генов, связанных с ремоделированием
матрикса (COLs, MMPs и TIMPs. ADAMs, HAS1) и контактами клетка-матрикс
(интегрины). Эти данные указывают на активацию стромальной функции МСК,
которая, судя по транскрипционном профилю, более эффективно увеличивается при
5% О2. Экспансия ГСПК при 5% О2 позволяет увеличить долю
CD34+ клеток в популяции ГСПК и обеспечить преимущественное развитие
определенных гемопоэтических ростков.
МСК-ассоциированные ГСПК включали
субпопуляцию CD45+/CD90+ некоммитированных предшественников, поддерживающих
длительное восстановление кроветворения in vivo, что делает их востребованным
продуктом в клеточной терапии и регенеративной медицине. Взаимодействие с ГСПК
привело к увеличению транскрипции «иммуносупрессивных» генов МСК, что
обеспечило подавление активации лимфоидных предшественников, стимулированных
митогеном. Клеточные ассоциаты МСК-ГСПК демонстрировали выраженную ангиогенную
активность. Эти данные поддерживают предположение о целесообразности
использования МСК в качестве «третьей» ткани при аллогенном введении ГСПК.
Полученные результаты представляются важными как в
связи с тем, что направленная экспансия предшественников гемопоэтических клеток
ex vivo может иметь значение для нужд
регенеративной медицины, так и с точки зрения исследования фундаментальных
физиологических механизмов гемопоэза, в частности функционирования
гемопоэтических ниш. Анализ данных, полученных при использовании «физиологических»
низких концентраций О2, при моделировании гемопоэтического
микроокружения in vitro с
использованием МСК, позволяет заключить, что содержание кислорода может
существенных образом модулировать экспансию гемопоэтических стволовых клеток.
Моделирование микроокружения, характерного для тканевых локусов ГСПК in vivo, дает возможность исследования
фундаментальных механизмов взаимодействия стромальных и гемопоэтических клеток,
что может в дальнейшем быть использовано для оптимизации протоколов экспансии
коммитированных и недифференцированных гемопоэтических предшественников.
Таким
образом, понимание фундаментальных механизмов участия МСК в различных
физиологических и репаративных процессах невозможно без учета роли парциального
давления кислорода. Функциональный потенциал МСК в условиях «физиологической»
гипоксии обеспечивает адаптацию этих клеток к повреждающим факторам в
микроокружении, таким как острый гипоксический стресс, эффективное участие в
процессах физиологического и репаративного ремоделирования тканей, что
представляет не только академический интерес, но и может быть использовано в прикладном
аспекте для нужд клеточной терапии и регенеративной медицины.
* *
Член-корреспондент РАН Алексей Николаевич Томилин — директор Института цитологии
РАН (Санкт-Петербург).
Плюрипотентные стволовые клетки выдвинулись на передний край регенеративной
биомедицины в связи с широчайшими возможностями их применения для моделирования
заболеваний и тканезаместительной терапии у человека. В выступлении
представлены наиболее значимые результаты исследований докладчика, касающиеся
как фундаментальных вопросов регуляции клеточной плюрипотентности, так и
перспектив внедрения плюрипотентных стволовых клетках в практическое русло. В
выступлении также затронута важная тема новых вызовов для биомедицины,
обсуждены возможные пути их решения.
В
обсуждении приняли участие:
член-корр. М.А. Лагарькова; ак. Г.Я. Красников; ак. А.Д. Каприн —
генеральный директор ФГБУ «НМИЦ радиологии» Минздрава России, директор МНИОИ
имени П.А. Герцена, главный внештатный онколог Минздрава России; ак. В.И.
Стародубов; ак. Е.Л. Чойнзонов; ак. А.А. Камалов; ак. Г.Т. Сухих; ак. В.П.
Чехонин.
х х
х
Члены Президиума заслушали сообщение «О
Программе фундаментальных научных исследований в Российской Федерации на
долгосрочный период (2021-2030 годы)».
Информация академика РАН Александра Михайловича Сергеева.
х х
х
Члены Президиума заслушали сообщение «О
проведении в Российской Федерации Года науки и технологий».
Информация академика РАН Александра Михайловича Сергеева.
х х
х
Члены Президиума обсудили и приняли
решения по ряду других научно-организационных вопросов.