Сотрудники лаборатории гликохимии
Института органической химии им. Н. Д. Зелинского Российской
академии наук ведут исследования в области химии сиаловых кислот.
В одной из последних работ проведён сравнительный анализ реакционной
способности известных и новых гликозил-доноров, содержащих различные
защитные и уходящие группы, на примере их реакций с метанолом
и изопропиловым спиртом. Результаты исследования опубликованы в
журнале Carbohydrate
Research.
Углеводы играют важную роль во множестве процессов,
протекающих в живой природе, включая патогенез различных заболеваний
человека, что подчеркивает их значительный терапевтический потенциал. Одним
из ключевых и в то же время сложных направлений
в химии углеводов является реакция гликозилирования. Особые трудности
вызывает химический синтез гликозидов биологически значимых сиаловых кислот,
таких как нейраминовая и дезаминонейраминовая кислоты, что
обусловлено низкой воспроизводимостью и недостаточной селективностью
реакций гликозилирования с участием производных сиаловых кислот
(сиалилирования).
В лаборатории гликохимии ИОХ РАН ведутся активные
исследования в области химии сиаловых кислот. В одной
из последних работ проведён сравнительный анализ реакционной способности
известных и новых гликозил-доноров, содержащих различные защитные
и уходящие группы, на примере их реакций с метанолом
и изопропиловым спиртом.
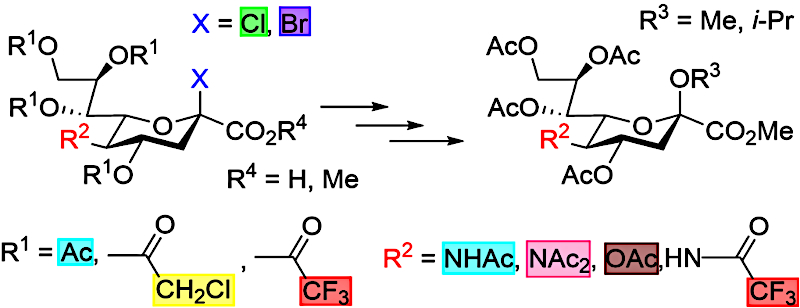
В результате были выявлены несколько
сиалилгалогенидов, обладающих более высокой реакционной способностью
и стереоселективностью в гликозилировании как первичных,
так и вторичных спиртов по сравнению с «эталонным» N,O-ацетилсиалилхлоридом
— первым гликозил-донором, широко применявшимся для сиалилирования.
Полученные данные подтверждают выдвинутую ранее
гипотезу о том, что электроноакцепторные N- и O-защитные группы
дестабилизируют гликозил-катион и повышают стереоселективность реакции
сиалилирования, направляя реакцию по ассоциативному SN2-подобному
маршруту.
Источник: ИОХ
РАН.