AstaP – группа каротиноид-связывающих белков,
обнаруженных в микроводорослях. «Ядро» белка AstaP составляет домен FAS1,
широко распространенный в различных организмах — от бактерий до человека.
Ранее этот домен был описан только для белков клеточной адгезии. AstaPo1 –
первый белок, для которого была обнаружена новая функция, которую может
выполнять FAS1 домен: связывание каротиноидов. Сотрудники группы
«Белок-белковые взаимодействия» ФИЦ Биотехнологии РАН и лаборатории
биомолекулярной ЯМР-спектроскопии Института биоорганической химии им.
академиков М. М. Шемякина и Ю. А. Овчинникова РАН (ИБХ РАН)
исследовали пространственную структуру AstaPo1 и её связь с функцией белка.
Результаты работы опубликованы в журнале Communications biology.
Каротиноиды – мощные антиоксиданты, помогающие клеткам
бороться с окислительным стрессом. Высокое содержание каротиноидов в диете
человека коррелирует с уменьшением риска нейродегенеративных расстройств,
различных видов рака, сердечно-сосудистых и офтальмологических заболеваний. Так
как окислительный стресс либо является причиной, либо сопровождает данные
заболевания, то если использовать каротиноиды в качестве антиоксидантов,
возможно предупредить, затормозить или остановить их развитие. Однако, крайне
низкая растворимость (за счет высокой гидрофобности) молекул каротиноидов
является одним из препятствий для их применения в терапевтических целях. В
качестве решения этой проблемы могут подойти природные солюбилизаторы –
каротиноид-связывающие белки.
AstaP – группа каротиноид-связывающих белков,
обнаруженных в микроводорослях. «Ядро» белка AstaP составляет домен FAS1,
широко распространенный в различных организмах, от бактерий до человека.
Ранее этот домен был описан только для белков клеточной адгезии. AstaPo1 –
первый белок, для которого была обнаружена новая функция, которую может
выполнять FAS1 домен: связывание каротиноидов. Кроме того, в отличие от других
известных каротиноид-связывающих белков AstaPo1 гораздо более универсален: он
может образовывать комплекс с различными соединениями – астаксантином,
кантаксантином, лютеином, зеаксантином и β-каротином.
Структура комплекса AstaPo1 с молекулой астаксантина
была определена при помощи ЯМР-спектроскопии, метод ранее никогда не
использовался для изучения белков в комплексах с каротиноидами.
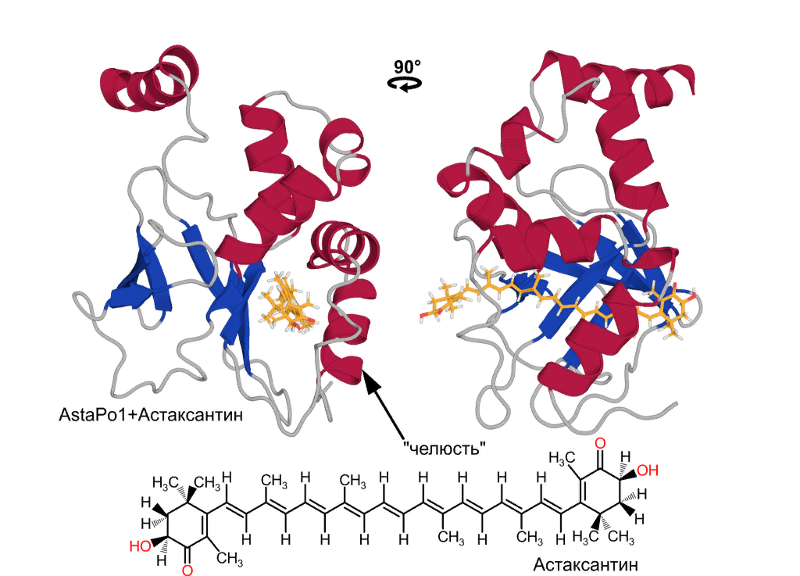
Трехмерная структура комплекса AstaPo1 с молекулой
каротиноида астаксантина.
Оказалось, что AstaPo1 связывает астаксантин в
гидрофобном туннеле, при этом длины туннеля не хватает, чтобы поместить туда
всю молекулу. В результате, концевые «кольца» астаксантина находятся в водном
окружении, а в “пасть” белка попадает только его “жирная” цепочка. Таким
образом, взаимодействие между лигандом и AstaPo1 получается неспецифическим.
Это объясняет широкий набор каротиноидов, которые связывает AstaPo1.
Трехмерная структура AstaPo1 была использована для
поиска характеристик, которые позволяют доменам FAS1 связывать молекулы
каротиноидов. C этой целью был проведен биоинформатический анализ, сделаны
точечные мутации и измерена активность разных вариантов белка. Оказалось, что
замены аминокислот в гидрофобном туннеле не мешают связыванию каротиноидов,
поэтому, вероятно, секрет этой функции доменов FAS1 скрыт не в свойствах
туннеля, а в том, каким образом происходит захват молекул из мембран клеток.
Для анализа механизмов захвата были сделаны укороченные версии белка, в которых
удаляли неупорядоченные фрагменты, которые, как выяснилось, также не влияют на
образование комплекса белка с каротиноидами. С одной стороны, это позволило
значительно уменьшить минимальный размер активного белка, с другой, причины, по
которым белки схожей структуры не в состоянии связывать и переносить
каротиноиды, в то время как AstaPo1 может это делать, так и остались загадкой.
Тем не менее, в результате анализа трехмерной
структуры и подвижности белка без астаксантина и в комплексе с ним, удалось
предложить механизм, по которому AstaPo1 может связывать каротиноиды из
мембраны клеток. В процессе предположительно участвует область молекулы,
которая была названа «челюстью». Эта «челюсть”, состоящая из двух спиральных
участков, может отсоединяться от остальной молекулы белка и, по-видимому, в
состоянии погрузиться в мембрану и связать длинную цепочку каротиноида.
Работа поддержана при поддержке
национального проекта «Наука и университеты» (субсидия Министерства Образования
и Науки № 075-15-2021-1354), а также грантом Президента РФ № МД 2834.2022.1.4.
Источник: ФИЦ Биотехнологии РАН.